BioRoot™ RCS – czy możliwa jest zmiana paradygmatu wypełniania kanału korzeniowego?
BioRoot™ RCS – czy możliwa jest zmiana paradygmatu wypełniania kanału korzeniowego?
Spis treści
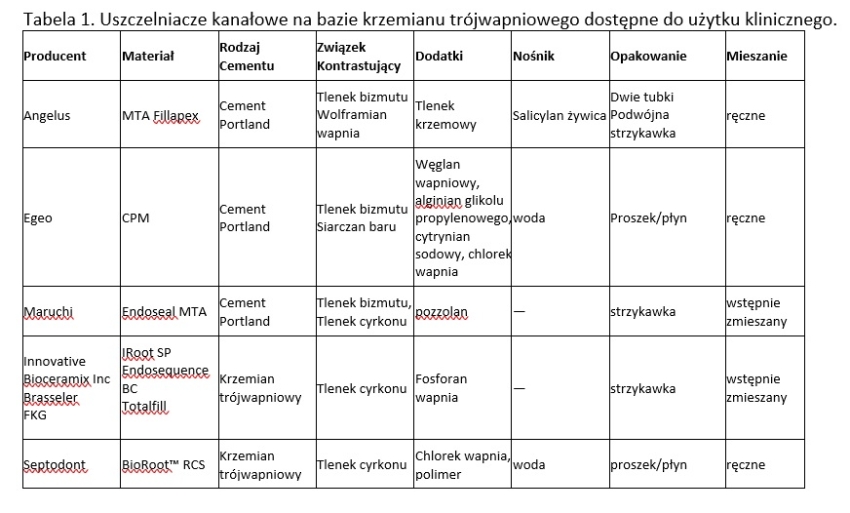
Wprowadzenie hydraulicznych materiałów na bazie krzemianu wapniowego jako uszczelniaczy kanałów korzeniowych stanowi ostatnie osiągnięcie prac nad udoskonalaniem oryginalnego preparatu MTA. W pierwszym badaniu ocenie poddano stosowanie MTA jako uszczelniacza kanału korzeniowego w połączeniu z gutaperką (1). Zastosowanie MTA jako uszczelniacza spowodowało powstanie zmineralizowanych tkanek, a zatem dotyczyło procesu biomineralizacji i reakcji tkankowych na MTA oraz jego zdolność do uwalniania jonów wapnia (2). Zastosowanie MTA jako uszczelniacza wpłynęło na większą nieszczelność w okolicy wierzchołkowej niż wypełnienie gutaperką (3). Mechanizm działania MTA i jego mechanizmów hydratacji opisano w literaturze później (4-6), a następnie wprowadzono komercyjne uszczelniacze kanału korzeniowego. Pierwsze na rynku zostały opracowane w 2008 r. Przez Egeo i Angelusa (7). W tym samym czasie opublikowano również artykuł na temat produktu ProRoot Endo Sealer opracowanego przez Dentsply (8), ale ten uszczelniacz nie został wprowadzony oficjalnie jeszcze na rynek. Wybór dostępnych do tej pory uszczelniaczy pokazano w tabeli 1. Wśród tych uszczelniaczy jest BioROOT™ RCS opracowany przez Septodont. W tym artykule omówiono skład i właściwości tego właśnie materiału.
Skład
BioRoot™ RCS to preparat o najprostszym składzie jaki pokazano w Tabeli 1. Jest oparty na wodzie, a zmiana konsystencji z cementu na uszczelniacz zależy od zawartość rozpuszczalnego w wodzie polimeru, który warunkuje płynność materiału. Pierwsze zastosowanie rozpuszczalnego w wodzie polimeru dodanego do cementu portlandzkiego, w celu poprawy właściwości materiału, zostało opisane w 2005 r. (9). Użycie rozpuszczalnego w wodzie polimeru do tworzenia uszczelniacza kanałowego poddano następnie ocenie laboratoryjnej w 2009 r. (10). W tym badaniu zajmowano się różnymi dodatkami polimerowymi i obserwowano ich wpływ na ostateczne parametry materiału i właściwości hydratacyjne. Dodanie polimeru rozpuszczalnego w wodzie do MTA nie zmieniło właściwości hydratacyjnych materiału, ale spowodowało, że powstał materiał o ulepszonych właściwościach potencjalnie nadający się do stosowania jako cement endodontyczny (10). Ponadto nowy uszczelniacz na bazie MTA wykazał odpowiedni czas wiązania i był stabilny wymiarowo. Otrzymane właściwości okazały się ważnymi do wykorzystania w praktyce klinicznej stały się pretekstem do opracowania nowego cementu uszczelniającego kanał korzeniowy (11).
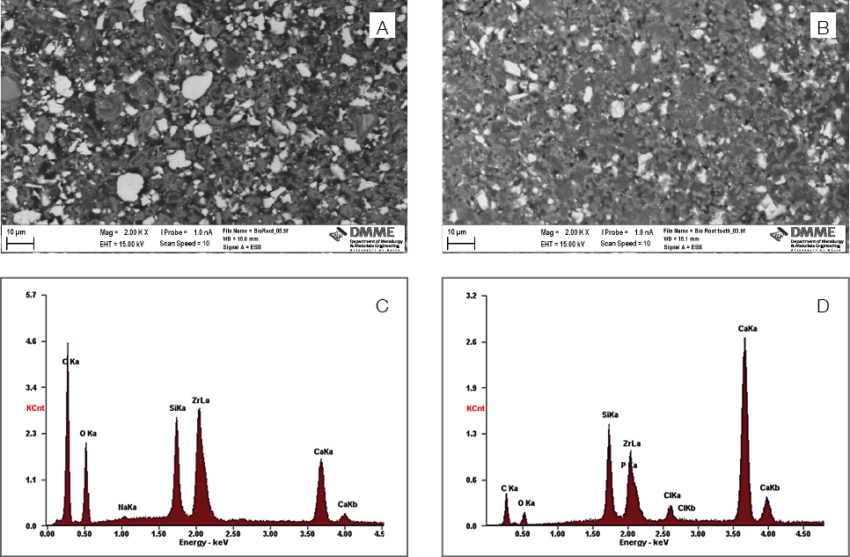
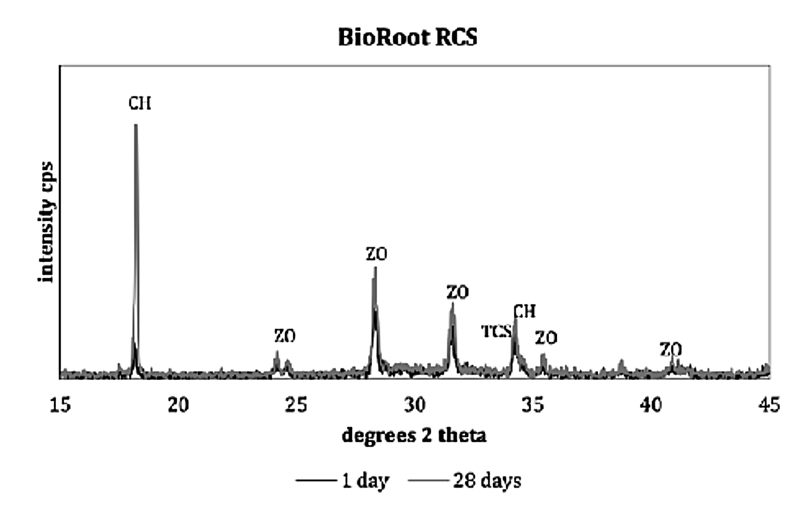
Jak pokazano na Fig. 1 BioRoot™ RCS jest dostępny w formie proszku i płynu. Proszek składa się z krzemianu trójwapniowego jako aktywnego składnika cementu kontrastowego tlenku cyrkonu (12). Płyn składa się z wody, chlorku wapnia, powidonu i polimeru rozpuszczalnego w wodzie. Mikrostrukturę uszczelniacza i analizę elementarną przedstawiono na rycinie 2 (A, C), a jej uwodnienie w okresie 28 dni z tworzeniem wodorotlenku wapnia pokazano na rycinie 3. Analiza elementarna została potwierdzona w innym, niedawnym badaniu (13). Po umieszczeniu w roztworze, uszczelniacz uwalnia wysokie poziomy jonów wapnia w porównaniu do innych materiałów na bazie krzemianu trójwapniowego, takich jak produkty Endosequence BC i MTA Fillapex (13).
Fig. 1. BioRoot™ RCS firmy Septodont w opakowaniu z pojemnikiem i miarką dla ampułek z proszkiem i płynem.
Fig. 2: Mikrostruktura powierzchniowa BioRoot™ RCS pokazująca główne fazy oraz analizy elementarne pokazane in vitro (A, C), a także w kontakcie z zębiną (B, D) wskazującą zmiany chemiczne, w tym tworzenie formacji fosforanów.(Przedruk za zgodą Xuereb i wsp. 2015)
Fig. 3: Hydratacja BioRoot™ RCS pokazująca fazy krystaliczne utworzone po 1 i 28 dniach po wymieszaniu, za pomocą dyfraktometrii rentgenowskiej (Przedruk za zgodą Xuereb i wsp. 2015)
Właściwości
Czas wiązania
Ostateczny czas wiązania BioRoot™ RCS wynosił 324 (± 1) minut, czyli mniej niż w przypadku AH Plus (15). MTA Fillapex nie związał w porównaniu do innych uszczelniaczy kanałowych na bazie krzemianu trójwapniowego (14, 15). Czas wiązania BioRoot™ RCS został drastycznie zredukowany w przypadku zastosowania zwiększonej temperatury w technikach kondensacji gutaperki na ciepło (16). Kontakt z wilgotnym środowiskiem znacznie wydłużył czas wiązania (14). W rzeczywistości producent zaleca stosowanie BioRoot™ RCS tylko w technikach wypełniania kanału korzeniowego na zimno, szczególnie w przypadku gutaperki w technice obturacji z pojedynczym ćwiekiem.
Rozpuszczalność
Wykazano, że BioRoot™ RCS jest mniej rozpuszczalny niż AH Plus i MTA Fillapex natychmiast po zanurzeniu w wodzie, ale jego rozpuszczalność była większa w dłuższym czasie, w porównaniu do uszczelniaczy na bazie żywicy (15). Rozpuszczalność zwiększa właściwości biologiczne uszczelniacza. Zanurzenie w soli fizjologicznej buforowanej fosforanem poprawiło rozpuszczalność BioRoot™ RCS w długim okresie, a osad powierzchniowy obserwowano po 14 i 28 dniach zanurzenia (15).
Płynność i grubość warstwy
BioRoot™ RCS wykazuje niższą płynność i większą grubość warstwy (12) niż wartości graniczne określone w zaleceniach ISO 6976, 2012 (17). Zalecenia ISO są przeznaczone dla obojętnych uszczelniaczy, w przeciwieństwie do BioRoot™ RCS. Na płynność i grubość warstwy ma wpływ ciepło zastosowane podczas procedury pionowej kondensacji gutaperki na ciepło (16). W tym przypadku producent w rzeczywistości zaleca stosowanie technik wypełniania na zimno
Kontrastowość
Okazało się, że nieprzepuszczalność promieniowa BioRoot™ RCS była większa niż dolna granica określona przez ISO 6876, 2012 (17) i podobna do wartości AH Plus i MTA Fillapex (15). Kontrastowość wyniosła około 9 mm grubości aluminium, czyli jest podobna do wartości uzyskanej dla uszczelniacza Endosequence BC i wyższa niż dla MTA Fillapex (14).
Uwalnianie jonów wapnia
Wykazano, że BioRoot™ RCS uwalnia wysoki poziom wapnia w roztworze, który jest znacznie wyższy niż inne podobne rodzaje uszczelniaczy. W rzeczywistości uwalnia on dwukrotnie większa ilość jonów niż uszczelniacz Endosequence BC i dziesięciokrotnie większej jonów wapnia niż MTA Fillapex przez te same okresy czasu, w identycznych warunkach (14). Wykazano biomineralizację i osadzanie fosforanów nad materiałem pozostającym w kontakcie z zębiną (14), co demonstruje Fig.2 (B, D).
Biomineralizacja
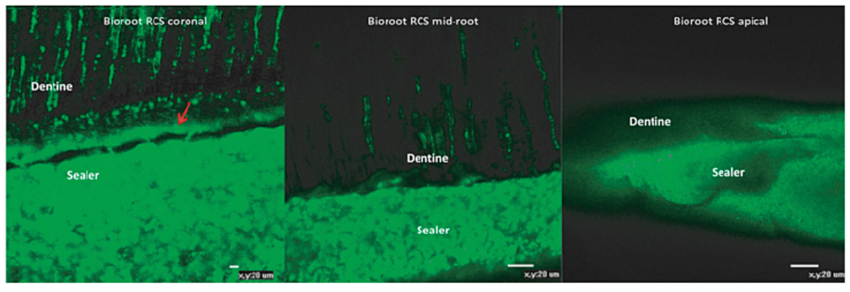
Stwierdzono, że kontakt materiałów na bazie krzemianu trójwapniowego z zębiną i tkankami powoduje osadzanie się fosforanów na powierzchni materiału. Zostało to szeroko opisane dla MTA (18-20). Interakcja między zębiną i Biodentine™ została również dobrze udokumentowana. Wiązanie chemiczne uzyskuje się w strefie mineralnej infiltracji w obszarze płaszczyzna kontaktu materiał-ząb (21). Ta właściwość jest ważna dla uszczelniaczy, ponieważ wiązanie uszczelniacza z zębiną kanałową prowadzi do zmniejszenia mikroprzecieku. Zjawisko mineralnej infiltracji w strefie płaszczyzn kontaktu potwierdzono dla BioRoot™ RCS przy użyciu mikroskopu konfokalnego (22). Infiltracja mineralna i wypustki uszczelniacza zapewniają doskonała adaptację materiału i wiązanie adhezyjne z zębiną kanału korzeniowego (ryc. 4). Wypustki i strefa bogata w związki mineralne były bardziej widoczne w części koronowej kanału niż w połowie i przy wierzchołku korzenia. Może to być spowodowane ograniczonym efektem działaniem irygacji EDTA (kwasem etyleno diamino tetraoctowego) i zredukowanym usunięciem warstwy mazistej w głębi kanału korzeniowego (23). Infiltracja jonów fosforu do materiału BioRoot™ RCS, gdy ta warstwa uszczelniająca ma kontakt z zębiną, nie została udowodnione. Analiza fazy powierzchni z zastosowaniem kątowej dyfrakcji rentgenowskiej nie potwierdziła powstania fosforanu wapnia w materiale kontaktującym się z zębiną. Zostało to wykazane za pomocą modelu in vitro- in vivo, w którym do oceny wiązania materiału i jego składu chemicznego wykorzystano kolumnę niskociśnieniową wypełnioną roztworem fizjologicznym. Badanie to jest bardziej wiarygodne niż w przypadku badań in vitro, w których stosuje się relatywnie duże objętości płynów, co znajduje odzwierciedlenia w warunkach klinicznych (14).
Fig. 4: Confocal microscopic images of BioRoot™ RCS interface with dentine at different levels along the root canal showing the mineral infiltration zone and sealer tags in dentinal tubules (Reprinted with permission from Viapiana et al. 2016).
W celu zwiększenia siły adhezji uszczelniacza do ścian kanału korzeniowego zasugerowano użycie buforowanego fosforanem roztworu soli fizjologicznej (23). Doprowadziłoby to do poprawy dostępności jonów fosforanowych, zwiększając w ten siłę wiązania adhezyjnego na granicy faz. Odkładanie się fosforanu wapnia wiązało się ze wzrostem siły wypychania materiałów uszczelniających na bazie krzemianu trójwapniowego (24).
W porównaniu do MTA Fillapex i AH Plus, BioRoot™ RCS wykazał największą aktywność przeciwbakteryjną. Materiały do uszczelniania kanału korzeniowego wywierały większą aktywność przeciwdrobnoustrojową, gdy EDTA był stosowany jako końcowy środek płuczący.
Niestety przeciwbakteryjne właściwości BioRoot™ RCS i innych uszczelniaczy o podobnej budowie chemicznej, w tym AH Plus, wykazały zmniejszenie tych właściwości, gdy roztwór soli fizjologicznej buforowany fosforanem był używany jako końcowy środek płuczący podczas leczenia endodontycznego (25).
Biokompatybilność
Elucje z BioRoot™ RCS, a nawet bezpośrednie wysiewanie komórek na materiale wykazały wysoki stopień proliferacji komórek. Zauważono, że migracja komórek macierzystych więzadeł ozębnej była wyższa w przypadku BioRoot™ RCS, a komórki zachowywały swój fenotyp mezenchymalny (26). Zostało to potwierdzone w innym badaniu testującym eluaty z BioRoot™ RCS i innych uszczelniaczy opartych na krzemianach trójwapniowych oraz AH Plus. Jednodniowa elucja materiałowa nie wykazała działania cytotoksycznego, natomiast ekstrakty 48- i 72-godzinne wykazywały lekką cytotoksyczność (27). Jednodniową elucję BioRoot™ RCS oceniano również w innym badaniu i nie zaobserwowano pęknięć dwuniciowych spirali DNA w porównaniu z innymi uszczelniaczami kanałowymi na bazie żywicy lub krzemianów. (28). BioRoot™ RCS nie wpłynął negatywnie na potencjał mineralizacji komórek macierzystych A4 z miazgi. Nie był tak cytotoksyczny jak Pulp Canal Sealer, który jest materiałem na bazie tlenku cynku z eugenolem. Nie pobudzał mezjalnych komórek macierzystych w kierunku różnicowania, ale zachował ich osteoodontogeniczne właściwości (29). BioRoot™ RCS wykazał również mniej toksyczny wpływ na komórki więzadła ozębnej niż Pulp Canal Sealer i indukował wyższą sekrecję angiogennych i osteogennych czynników wzrostu niż Pulp Canal Sealer (30).
Wypełnianie kanału BioRoot™ RCS
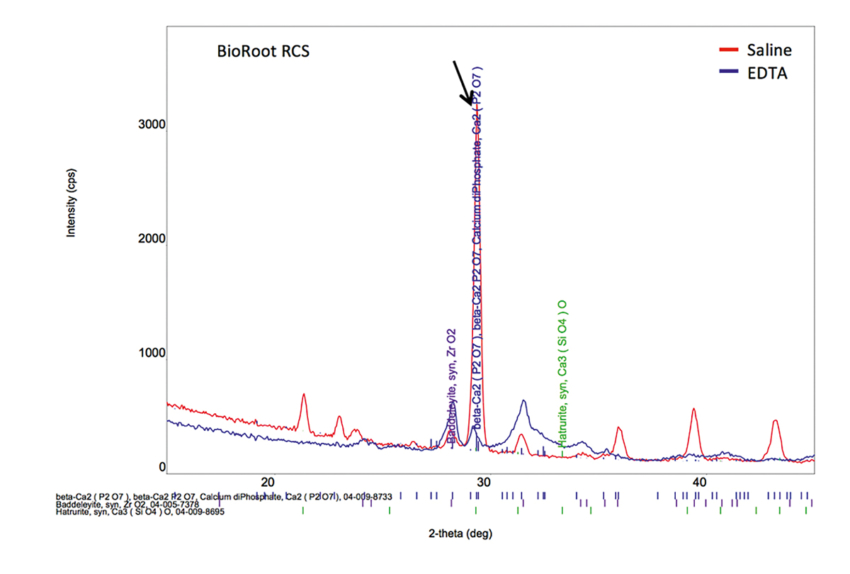
Na właściwości materiału BioRoot™ RCS ma wpływ stosowany protokół irygacyjny. Korzystanie z EDTA jako końcowego roztworu płuczącego doprowadziło do redukcji o połowę zdolności uwalniania jonów wapnia (31). Ponadto w kontakcie z zębiną nie powstaje faza fosforanu wapnia, gdy EDTA jest stosowany jako końcowy płyn do irygacji kanału (31). Na Fig. 5 pokazano porównanie utworzonych faz krystalicznych po użyciu soli fizjologicznej lub EDTA jako końcowego roztworu do irygacji czyli przed końcową obturacją wykonaną z użyciem z BioRoot™ RCS. Płukanie za pomocą EDTA wpłynęło na najwyższe właściwości przeciwbakteryjne materiału BioRoot™ RCS. Aktywność przeciwbakteryjna BioRoot™ RCS była znacznie wyższa niż materiału MTA Fillapex i AH Plus. BioRoot™ RCS wykazał największe właściwości antybakteryjne i to zostało dodatkowo wzmocnione przez zastosowanie roztworu EDTA do irygacji kanału (25). Użycie roztworów do płukania bogatych w fosforany jest przeciwwskazane przy przypadku wypełniania kanału pastą BioRoot™ RCS oraz wszystkimi innymi uszczelniaczami opartymi na krzemianach trójwapniowych.
Zastosowanie wyższej temperatury podczas pionowej kondensacji gutaperki na ciepła wpływa na płynność i grubość materiału pasty BioRoot™ RCS. W związku z tym zaleca się stosowanie tego materiału wypełniającego wyłącznie w technikach z pojedynczym ćwiekiem lub w bocznej kondensacji gutaperki (16). Przy wyborze techniki obturacji należy zawsze wziąć pod uwagę wybór właściwego rodzaju uszczelniacza.
Producent zaleca w przypadku BioRoot™ RCS zastosowanie techniki obturacji z pojedynczym ćwiekiem gutaperkowym, ponieważ ten materiał wypełniający ma właściwości przeciwbakteryjne, zatem jego obecność potencjalnie wyeliminowałaby wszelkie mikroorganizmy pozostawione w przestrzeni kanału korzeniowego oraz w kanalikach zębinowych. Wysoka aktywność przeciwbakteryjna materiału została udokumentowana i jest skuteczna niezależnie od zastosowanego systemu płukania (25).
Możliwość przeprowadzenie powtórnego leczenia endodontyczngo uszczelniacza, gdy użyto BioRoot™ RCS w połączeniu z gutaperką w technice obturacji pojedynczym ćwiekiem była lepsza w porównaniu do techniki z wykorzystaniem pasty AH Plus, ponieważ zaobserwowano mniej pozostałości po uszczelniaczu i krótsze czasy, jakie wymagało ponowne leczenia (32).
Wniosek
BioRoot™ RCS należy stosować w połączeniu ze ćwiekiem gutaperkowym w dowolnej technice obturacji na zimno. Materiałowa rozpuszczalność wzmaga reaktywność materiału prowadząc do środowiskowej wymiany jonów i sprzyjając w ten sposób indukowaniu biologicznej odpowiedzi. BioRoot™ RCS ma silne działanie przeciwbakteryjne, a zastosowanie EDTA zwiększa jego aktywność antybakteryjną.
Materiał nie została opracowany w celu spełnienia klasycznych zaleceń hermetycznego uszczelnienia, ponieważ ma na celu stworzenie w kanale korzeniowym środowiska, które zwiększa aktywność biologiczną i utrzymuje aktywność przeciwbakteryjną. Tak więc dzięki właściwościom materiału BioRoot™ RCS możliwa jest zmiana paradygmatu współczesnego leczenia kanałowego.
Ryc. 5: Wykres dyfrakcji rentgenowskiej BioRoot™ RCS po kontakcie z zębiną płukaną solą fizjologiczną lub EDTA. Zaznaczono czarną strzałką zmniejszenie złogów fosforanu wapnia na materiale w kontakcie z zębiną po irygacji EDTA. (Przedruk za zgodą Harika i wsp. 2016)
Josette Camilleri
B.Ch.D., M.Phil., Ph.D., FICD, FADM, FIMMM, FHEA (UK)
School of Dentistry, Instytut Nauk Klinicznych
College of Medical and Dental Sciences
Uniwersytet Birmingham
Wielka Brytania
Biografia

Pracowała na Wydziale Inżynierii Lądowej i Budowlanej, Wydział Inżynierii Środowiskowej Uniwersytetu Maltańskiego oraz w Katedrze Stomatologii Zachowawczej Wydziału Chirurgii Stomatologicznej Uniwersytetu Maltańskiego. Obecnie jest starszym wykładowcą w School of Dentistry, University of Birmingham, Wielka Brytania. Jej zainteresowania badawcze obejmują materiały endodontyczne, takie jak materiały do stałego wypełniania kanałów korzeniowych i uszczelniacze kanałowe, ze szczególnym uwzględnieniem mineralnych trójtlenków agregacyjnych, hydratacyjnego cementu portlandzkiego i innych materiałów cementowych, wykorzystywanych jako biomateriały, a także w budownictwie przemysłowym.
Josette opublikowała ponad 100 artykułów w recenzowanych czasopismach międzynarodowych, a jej prace były cytowana ponad 4000 razy. Jest redaktorką „Agregacyjne trójtlenki mineralne. Od przygotowania do aplikacji” opublikowanej przez Springer w 2014 r. Jest współautorką 7. edycji „Endodoncji Harty’ego w praktyce klinicznej” (Redaktor: BS Chong) oraz „Cementów glasjonomerowych w stomatologii” (Redaktor: SK Sidhu). Jest międzynarodowym wykładowcą, recenzentem i członkiem panelu naukowego wielu międzynarodowych czasopism, w tym Journal of Endodontics, Scientific Reports, Dental Materials, Clinical Oral Investigation, Journal of Dentistry, Acta Odontologica Scandinavica i Acta Biomaterialia.
Piśmiennictwo
- Holland R, de Souza V, Nery MJ, Otoboni Filho JA, Bernabé PF, Dezan Júnior E. Reaction of dogs’ teeth to root canal filling with mineral trioxide aggregate or a glass ionomer sealer. J Endod. 1999 Nov;25(11):728-30.
- Holland R, de Souza V, Nery MJ, Bernabé oF, Filho JA, Junior ED, Murata SS. Calcium salts deposition in rat connective tissue after the implantation of calcium hydroxide-containing sealers. J Endod. 2002 Mar;28(3):173-6.
- Vizgirda PJ, Liewehr FR, Patton WR, McPherson JC, Buxton TB. A comparison of laterally condensed guttapercha, thermoplasticized gutta-percha, and mineral trioxide aggregate as root canal filling materials. J Endod. 2004 Feb;30(2):103-6.
- Camilleri J, Montesin FE, Brady K, Sweeney R, Curtis RV, Ford TR. The constitution of mineral trioxide aggregate. Dent Mater. 2005 Apr;21(4):297-303.
- Camilleri J. Hydration mechanisms of mineral trioxide aggregate. Int Endod J. 2007 Jun;40(6): 462-70.
- Camilleri J. Characterization of hydration products of mineral trioxide aggregate. Int Endod J. 2008 May;41(5):408-17.
- Monteiro Bramante C, Demarchi AC, de Moraes IG, Bernadineli N, Garcia RB, Spångberg LS, Duarte MA. Presence of arsenic in different types of MTA and white and gray Portland cement. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 Dec;106(6):909-13.
- Weller RN, Tay KC, Garrett LV, Mai S, Primus CM, Gutmann JL, Pashley DH, Tay FR. Microscopic appearance and apical seal of root canals filled with gutta-percha and ProRoot Endo Sealer after immersion in a phosphate-containing fluid. Int Endod J. 2008 Nov;41(11): 977-86.
- Camilleri J, Montesin FE, Di Silvio L, Pitt Ford TR. The chemical constitution and biocompatibility of accelerated Portland cement for endodontic use. Int Endod J. 2005 Nov; 38(11):834-42.
- Camilleri J. Evaluation of selected properties of mineral trioxide aggregate sealer cement. J Endod. 2009 Oct;35(10):1412-7.
- Camilleri J, Mallia B. Evaluation of the dimensional changes of mineral trioxide aggregate sealer. Int Endod J. 2011 May;44(5):416-24.
- Khalil I, Naaman A, Camilleri J. Properties of Tricalcium Silicate Sealers. J Endod. 2016 Oct; 42(10):1529-35.
- Reszka P, Nowicka A, Lipski M, Dura W, Droździk A, Woźniak K. A Comparative Chemical Study of Calcium Silicate-Containing and Epoxy Resin-Based Root Canal Sealers. Biomed Res Int. 2016;2016:9808432.
- Xuereb M, Vella P, Damidot D, Sammut CV, Camilleri J. In situ assessment of the setting of tricalcium silicate-based sealers using a dentin pressure model. J Endod. 2015 Jan;41(1): 111-24.
- Prüllage RK, Urban K, Schäfer E, Dammaschke T. Material Properties of a Tricalcium Silicate- containing, a Mineral Trioxide Aggregate-containing, and an Epoxy Resin-based Root Canal Sealer. J Endod. 2016 Dec;42(12):1784-1788.
- Camilleri J. Sealers and warm gutta-percha obturation techniques. J Endod. 2015 Jan;41(1): 72-8.
- International Standard Organisation (2012). ISO 6876; Dentistry — Root canal sealing materials.
- Sarkar NK, Caicedo R, Ritwik P, Moiseyeva R, Kawashima I. Physicochemical basis of the biologic properties of mineral trioxide aggregate. J Endod. 2005 Feb;31(2):97-100.
- Tay FR, Pashley DH, Rueggeberg FA, Loushine RJ, Weller RN. Calcium phosphate phase transformation produced by the interaction of the portland cement component of white mineral trioxide aggregate with a phosphate-containing fluid. J Endod. 2007 Nov;33(11): 1347-51.
- Reyes-Carmona JF, Felippe MS, Felippe WT. Biomineralization ability and interaction of mineral trioxide aggregate and white portland cement with dentin in a phosphate-containing fluid. J Endod. 2009 May;35(5):731-6.
- Atmeh AR, Chong EZ, Richard G, Festy F, Watson TF. Dentin-cement interfacial interaction: calcium silicates and polyalkenoates. J Dent Res. 2012 May;91(5):454-9.
- Viapiana R, Moinzadeh AT, Camilleri L, Wesselink PR, Tanomaru Filho M, Camilleri J. Porosity and sealing ability of root fillings with gutta-percha and BioRoot™ RCS or AH Plus sealers. Evaluation by three ex vivo methods. Int Endod J. 2016 Aug;49(8):774-82.
- Reyes-Carmona JF, Felippe MS, Felippe WT. A phosphate-buffered saline intracanal dressing improves the biomineralization ability of mineral trioxide aggregate apical plugs. J Endod. 2010 Oct;36(10):1648-52.
- Reyes-Carmona JF, Felippe MS, Felippe WT. The biomineralization ability of mineral trioxide aggregate and Portland cement on dentin enhances the push-out strength. J Endod. 2010 Feb;36(2):286-91.
- Arias-Moliz MT, Camilleri J. The effect of the final irrigant on the antimicrobial activity of root canal sealers. J Dent. 2016 Sep;52:30-6.
- Collado-González M, García-Bernal D, Oñate-Sánchez RE, Ortolani-Seltenerich PS(3), Lozano A, Forner L, Elena C, Rodríguez-Lozano FJ. Biocompatibility of three new calcium silicate- based endodontic sealers on human periodontal ligament stem cells. Int Endod J. 2016 Sep 26. doi: 10.1111/iej.12703. [Epub ahead of print]
- Poggio C, Riva P, Chiesa M, Colombo M, Pietrocola G. Comparative cytotoxicity evaluation of eight root canal sealers. J Clin Exp Dent. 2017 Apr 1;9(4):e574-e578.
- Eldeniz AU, Shehata M, Högg C, Reichl FX. DNA double-strand breaks caused by new and contemporary endodontic sealers. Int Endod J. 2016 Dec;49(12):1141-1151.
- Dimitrova-Nakov S, Uzunoglu E, Ardila-Osorio H, Baudry A, Richard G, Kellermann O, Goldberg M. In vitro bioactivity of Bioroot™ RCS, via A4 mouse pulpal stem cells.Dent Mater. 2015 Nov;31(11):1290-7.
- Camps J, Jeanneau C, El Ayachi I, Laurent P, About I. Bioactivity of a Calcium Silicate-based Endodontic Cement (BioRoot™ RCS): Interactions with Human Periodontal Ligament Cells In Vitro. J Endod. 2015 Sep;41(9):1469-73.
- Harik R, Salameh Z, Habchi R, Camilleri J. The effect of irrigation with EDTA on calcium-based root canal sealers: a SEM-EDS and XRD study. Journal of the Lebanese Dental Association 2016; 49:12-23.
- Donnermeyer D, Bunne C, Schäfer E, Dammaschke T. Retreatability of three calcium silicate- containing sealers and one epoxy resin-based root canal sealer with four different root canal instruments. Clin Oral Investig. 2017 Jun 22. doi: 10.1007/ s00784-017-2156-5. [Epub ahead of print].
Septodont Polska Sp. z o.o.
ul. Taneczna 18A, 02-829 Warszawa
tel.: +48 22 545 89 50
Dowiedz się więcej: https://www.septodont.com.pl/products/bioroot-rcs
POWIĄZANE ARTYKUŁY
Od rozliczenia 2022 r. deklaracje PIT-28 i PIT-28S składa się w terminie od 15 lutego do 30 kwietnia. Ryczałt za grudzień 2022 r. oraz za ostatni kwartał 2022 r. jest płatny do końca lutego 2023 r. W kolejnych latach ryczałt będzie płatny do 20. st...
Najpóźniej za kilka miesięcy Polska dołączy do grupy krajów UE, których obywatele mogą realizować e-receptę w innym niż macierzysty kraju członkowskim. To kolejna odsłona rozwoju cyfryzacji ochrony zdrowia na poziomie Wspólnoty. (...) Obecnie jedyn...
Posłanka Krystyna Skowrońska skierowała do ministra zdrowia kolejną interpelację, w której pyta, jak długo jeszcze potrwa zmiana wyceny świadczeń stomatologicznych. Przypomnijmy – w grudniu 2021 r. posłanka Krystyna Skowrońska skierowała do ministra...
Jest to podstawowa metoda leczenia kieszonek przyzębnych. W zależności od tego jak zaawansowane są zmiany chorobowe, stosuje się kiretaż zamknięty bądź otwarty. Kiretaż zamknięty, zwany także p......
Ubezpieczenie odpowiedzialności cywilnej zawodowej (tzw. ubezpieczenie OC zawodowe) w Polsce to rodzaj ubezpieczenia, które chroni przed konsekwencjami finansowymi wynikającymi z roszczeń osób trzecich o odszkodowanie za szkody spowodowane w wyniku w...
Pod koniec maja w czasopiśmie naukowym „Journal of Pediatric Surgery Case Reports” opublikowano opis przypadku młodej pacjentki, u której rozwinęła się zmiana przypominająca tkanki zęba, zawierająca zwapniałe skrzepy krwi. Guz zlokalizowany w pobliżu...
Wielu potencjalnych pacjentów, zwłaszcza tych zainteresowanych zabiegami z zakresu stomatologii estetycznej, poprzez media społecznościowe szuka odpowiedniego gabinetu lub danej usługi. Ale czy wykorzystanie znanego z mediów społecznościowych influen...
Placówki medyczne, które mają umowy, w których okres rozliczeniowy zakończył się w 2020 r. i był przedłużony do końca 2021 r., mogą wnioskować o rozliczenie 1/12 kontraktu aż do 31 grudnia 2023 r. Oddziały NFZ-u przyjmują wnioski do 10 grudnia br. W...
Wielu Polaków nie ma możliwości sfinansowania takich inwestycji, jak kupno mieszkania, budowa domu czy zakup samochodu własnymi środkami – pomocny może wówczas okazać się kredyt. Przed wzięciem kredytu warto jednak dowiedzieć, czym tak naprawdę jest ...
Na mocy zarządzenia prezesa NFZ-u, wycena świadczeń stomatologicznych udzielanych dzieciom i młodzieży do 19. roku życia zostaje podniesiona poprzez wzrost współczynnika korygującego z 1,3 do 1,5. Jak czytamy w rozporządzeniu, świadczenia ogólnosto...
Nieznana wcześniej bakteria bytująca w kanale korzeniowym zęba została odkryta przez naukowców z Uniwersytetu we Fryburgu (Niemcy). Ma ona zostać nazwana Radixoralia hellwegii – na cześć prof. dr. Elmara Hellwiga, byłego dyrektora Wydziału Stomatolog...





![Zębopodobna zmiana naczyniowa na policzku 12-latki [opis przypadku] 22 zmiana zebopochodna](https://dentonet.pl/wp-content/uploads/2022/05/zmiana_zebopochodna-150x150.jpg)